山本研では、病原性原虫や「がん」に対する免疫系とその破綻の研究しています
(1)病原性原虫に対する宿主免疫系の解析とその破綻の分子機構
マラリア・トキソプラズマ・トリパノソーマ原虫などが原因の種々の寄生虫感染症に我々人類は年間新たに数億人が感染しており、効果的な治療法が未だ確立されておらず毎年数十万人が命を落としています。ウイルスや細菌と異なり、寄生虫(原虫)は真核生物でありその多くは宿主細胞内に寄生胞と呼ばれる特殊なオルガネラを形成し、宿主との間で巧妙な相互作用を行って感染を成立させています。また原虫由来分子を標的とした薬剤に対する耐性原虫が出現し問題となっている昨今、この寄生胞という特殊な「原虫―宿主間の相互作用」の場に着目してその成立に深く関与する原虫由来因子と相互作用する宿主因子を同定することは、原虫感染症克服のための新規治療戦略の分子基盤を提供しうるものとして抗原虫宿主応答研究の中心のトピックの一つとなっています。
現在、山本研で進行中の感染免疫の具体的なプロジェクトとしては、トキソプラズマ原虫をモデル病原性寄生虫として取り上げ、
①トキソプラズマ原虫を破壊しようとする宿主免疫機構の解析
② 高病原性トキソプラズマの免疫抑制機構あるいは免疫ハイジャック機構の解明
③ さらに色々な細胞内寄生性病原体に対する感染免疫への一般化
☞ 動画での研究紹介はこちら (英語ですが、日本語字幕ついています)
トキソプラズマ原虫はマラリア症の原因病原体であるマラリア原虫などと同じ胞子虫類原虫に分類され、宿主の細胞の中でのみ増殖可能な偏性細胞内寄生生物です。感染可能な細胞の種類はすべての有核の細胞であり、赤血球あるいは肝臓細胞のみにしか感染できないマラリア原虫とは比較にならないぐらいの多数の細胞系譜がトキソプラズマ原虫の標的細胞となります。それらの細胞にトキソプラズマ原虫はその三日月形の先端部に存在する複合体(アピカルコンプレックス)を用いて能動的に侵入します。標的細胞に密着して1分以内に細胞内に侵入し、ロプトリーと呼ばれる分泌小器官から様々な分子を宿主細胞質内に放出します。さらに感染細胞内では寄生胞(Parasitophorous vacuole = PV)と呼ばれる細胞内小器官を形成し、その中で原虫が増殖するのに必要な栄養分の摂取を行っています。約6時間を1細胞周期として細胞分裂を繰り返し寄生胞中の原虫数が経時的に増大し、やがて感染細胞の細胞質のほとんどが寄生胞中の原虫となると寄生胞が消失し宿主細胞を破裂させ、近接した別の細胞に感染し感染部位を拡大させていきます。近年の分子生物学的研究の進展の結果、トキソプラズマ原虫は寄生胞中に様々の分子を分泌し、それらが効率増殖するために極めて多彩な機能を有していることが分かってきました。
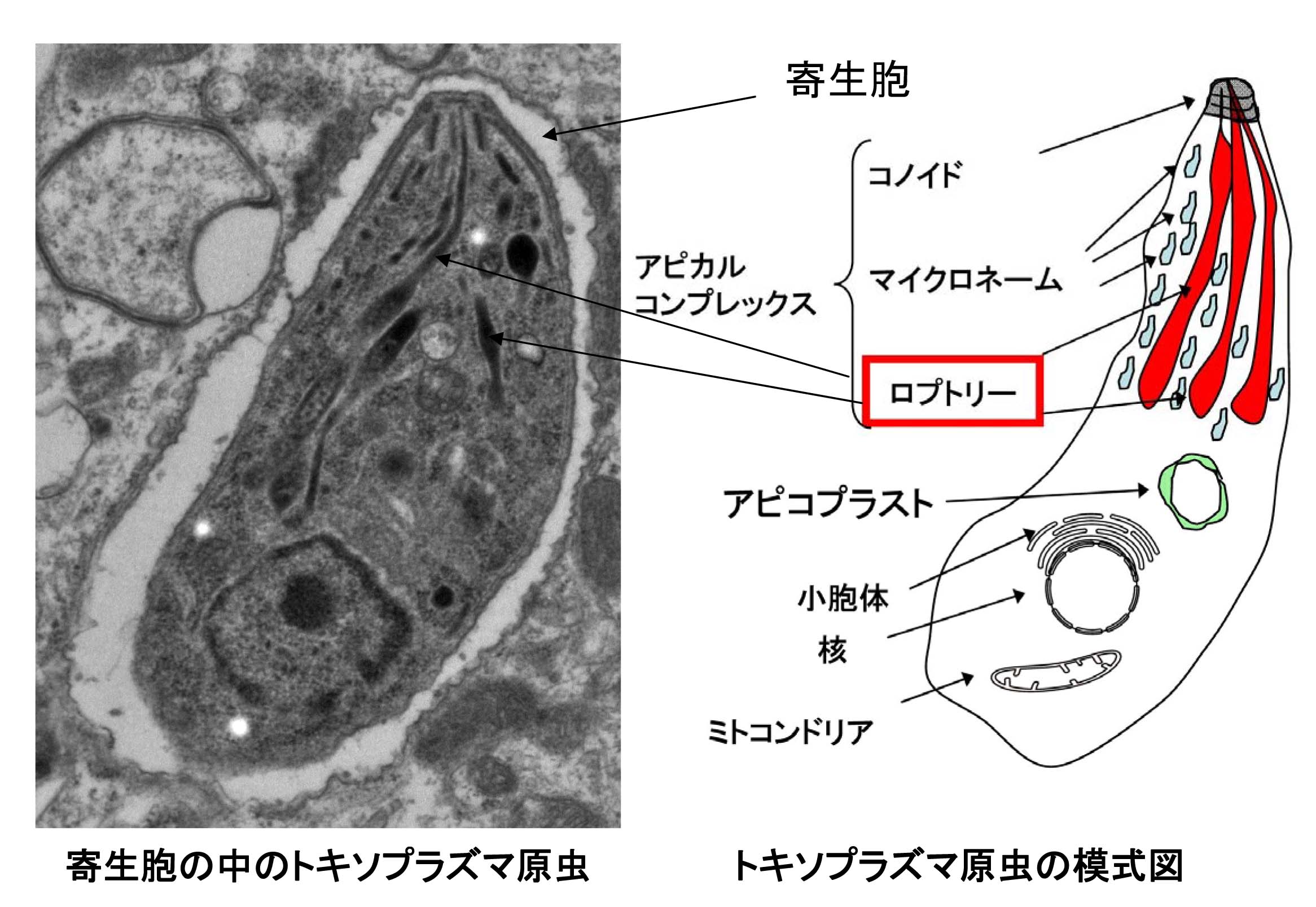
私たちはトキソプラズマ原虫やマラリア原虫が宿主細胞感染時に寄生胞(PV)の中や宿主細胞質内に放出するエフェクター分子が原虫の病原性に深く関係し、「原虫―宿主間の相互作用」を明らかにする上で特に重要であると考えて研究しています。具体的には、宿主因子の遺伝子改変マウスの作製と解析のみならず、ノックアウト原虫の作製やトランスジェニック原虫のデザインを分子遺伝学と分子生物学を駆使して自由自在に行ってエフェクター分子の病原性における役割を解析するという、原虫側からと宿主側からの“二刀流”のアプローチをしています。エフェクター分子には、それがターゲットとする宿主因子があります。多くの場合は、宿主の自然・獲得免疫系に関与する分子が標的となっていることが、私たちのグループや海外の研究グループ激しい競争の中で明らかにしてきました。また最近では「こんな宿主因子がエフェクター分子のターゲットになっているのか!?」という大変面白い結果が、色々と明らかになってきています。
また私たちは最近CRISPR遺伝学とプログラミング(Rを使った大規模統計解析)によって、トキソプラズマ原虫をマウス生体内でCRISPRスクリーニングする方法(in vivo CRISPRスクリーン法)を開発しました (研究内容14,Cell Rep. 2023; 研究内容17, mBio 2024)。この方法を使うとこれまで約20年かけて世界中のトキソプラズマ原虫の研究者が一つ一つ調べてきた病原性因子群を、わずか1か月で、しかも、重要な遺伝子のランキングをつけて根こそぎ同定できます。
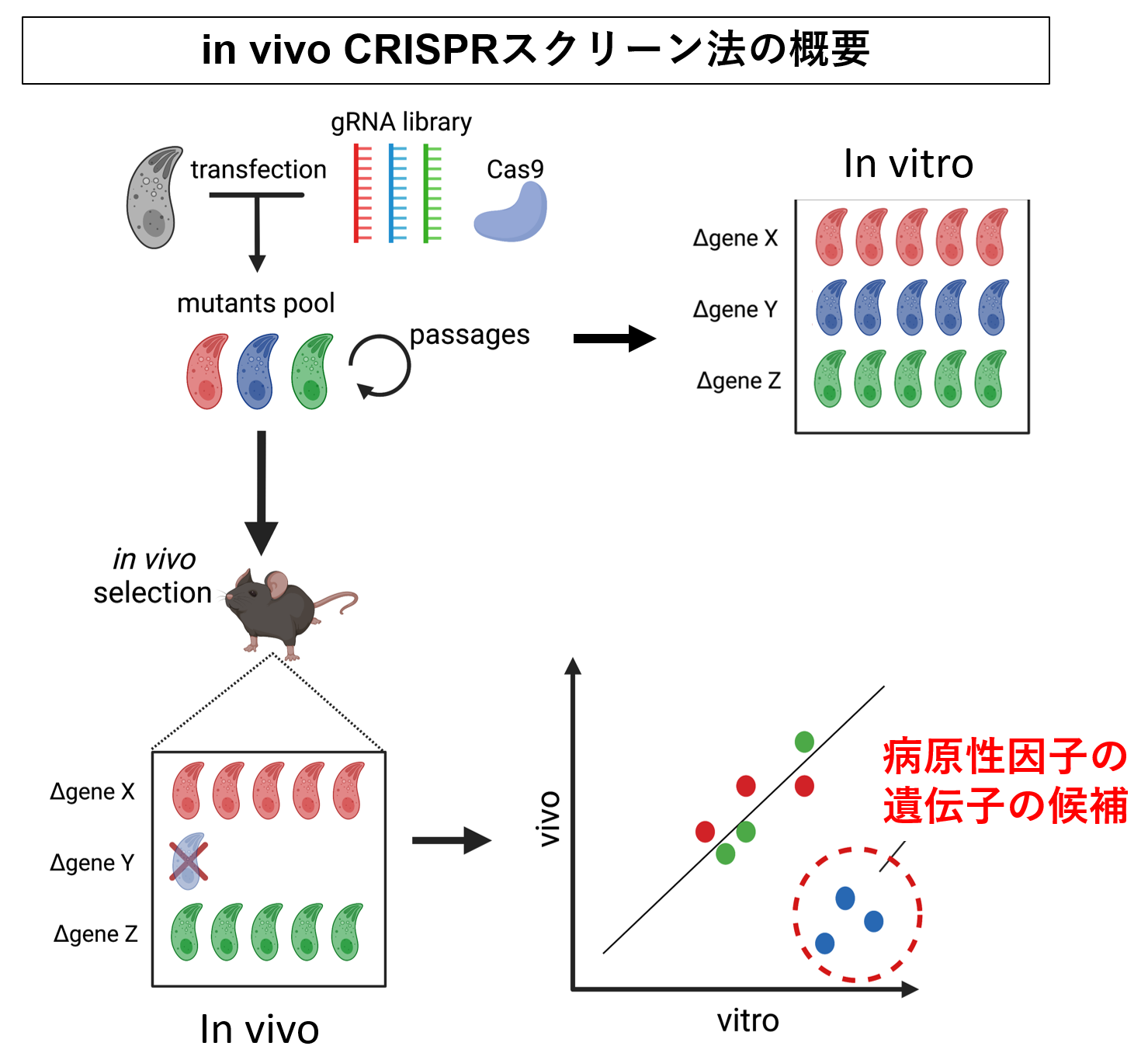
そして、これらの研究で分かったことは、トキソプラズマ原虫の病原性因子は、原虫が宿主細胞内に放出する分子だけにとどまらず、様々な非分泌型分子が存在するということです。いわば、多くても250種類程度しかないロプトリーなどから放出されるエフェクター分子群は病原性因子として「氷山の一角」に過ぎず、むしろ、残りの約7700個の遺伝子の中に機能が未解明の重要な病原性因子がまだまだたくさんあるという「宝の山」を見つけています。

現在もっとこれら宝の山の病原性因子群をどのようにして解析するのか、大学院生やスタッフが頭を悩ませながら日々頑張っている所です。みなさんも一緒に、トキソプラズマ原虫の新しい病原性機構や、さらにその向こうにあるマラリア原虫やクリプトスポリジウム原虫にも効果がある新規の胞子虫類原虫治療法の開発に取り組んでみませんか?
(2) 腫瘍に対する宿主免疫系「がん免疫」とその破綻の分子機構
2021年以来、がん免疫の研究も開始しました。トキソプラズマに対する感染免疫で重要なPLCβ4のノックアウトマウスの解析を行っていた時に、PLCβ4 KOマウスはトキソプラズマのみならず、マウスの皮膚がんモデルであるB16F10に対しても弱くなることを見つけました(研究内容12= J Exp Med, 2021)。宿主はトキソプラズマに感染した細胞を除去しようとしてキラーT細胞やTh1、NK細胞を主体とするI型免疫応答の「感染免疫」を引き起こすのですが、よくよく考えてみると、この構図は「トキソプラズマに感染した細胞」を「がん」に置き換えると、「がん免疫」の構図となります。つまり、がん細胞とトキソプラズマ感染宿主細胞は、色々変異が蓄積してしまって異物(非自己)になってしまったのか、それとも外来の生物に感染されて異物になってしまったという過程に違いはありますが、結局、宿主免疫系からみれば、非自己化してしまった元自己細胞を除く反応がI型免疫応答で、がん免疫と(原虫の)感染免疫は酷似しています。がん細胞は自分由来の原虫(感染細胞)のようですし、またトキソプラズマ感染細胞は外来のがん細胞とも言えます。
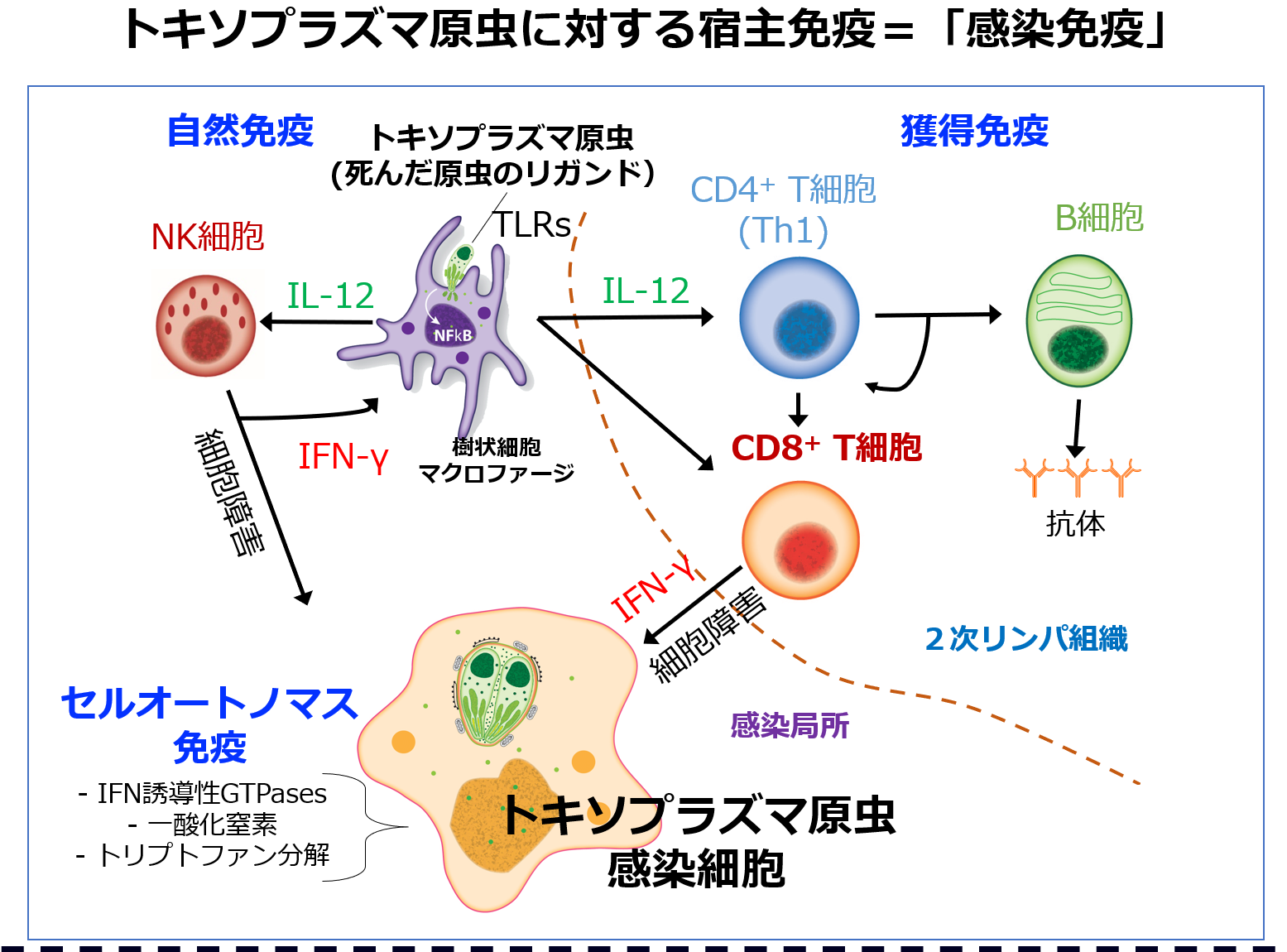
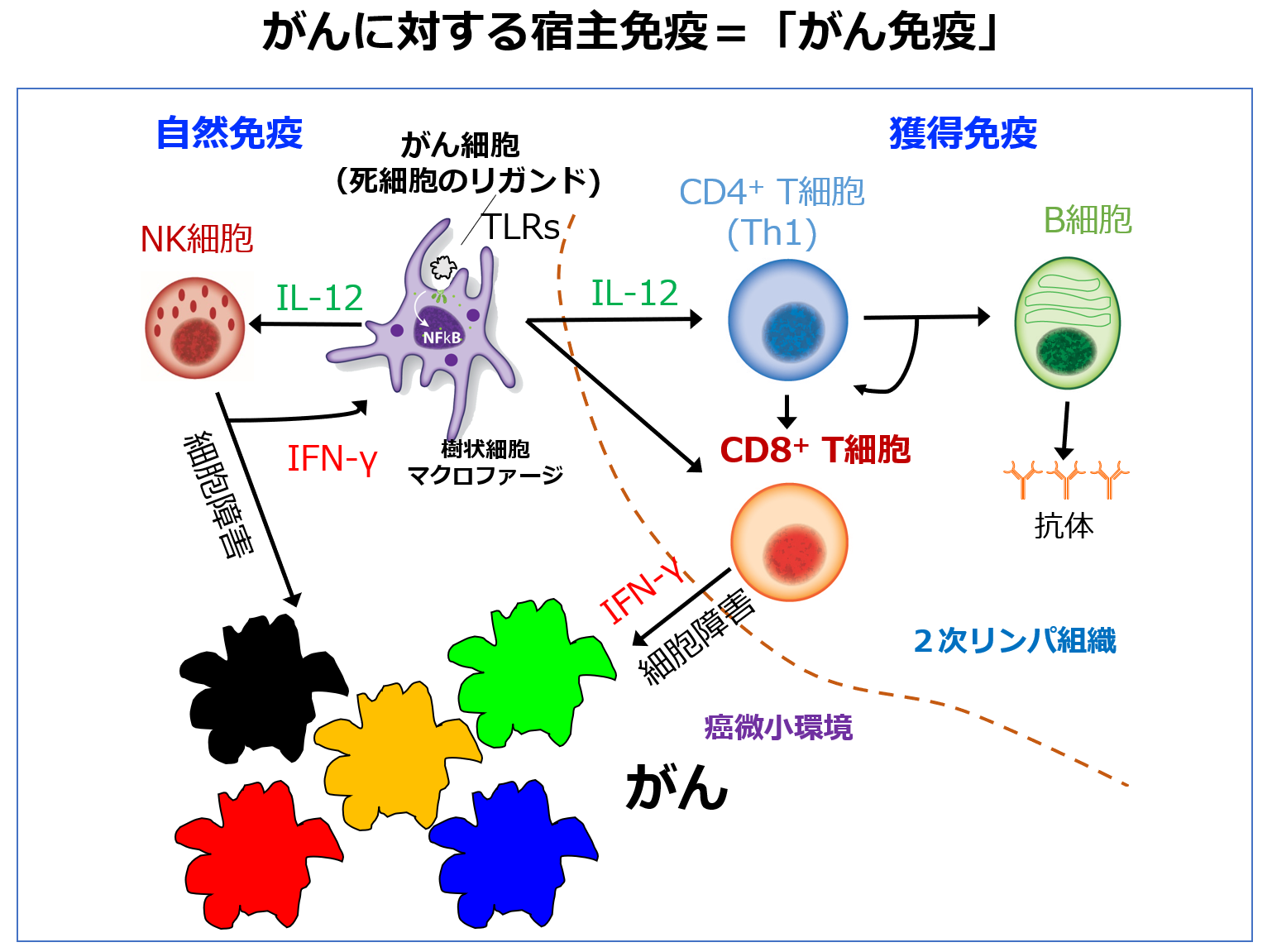
どうでしょうか。抗トキソプラズマ原虫の「感染免疫」と「がん免疫」はよく似ていると思いませんか?
また、がんに対する宿主免疫ががん免疫ですが、がんはがん免疫を色々な方法で抑制しようとしています。これは、トキソプラズマが色々な方法で感染免疫を抑制しようとする姿に酷似しています。ですから、トキソプラズマの感染免疫抑制機構とがんによるがん免疫抑制機構も似たような細胞が使われています。その一例が、Th1型制御性T細胞(Th1-Treg)ですが、Th1-TregのようなTregの亜集団(サブセット)の解析手法はコンディショナルノックアウトマウス以外にありませんでした。これは、マクロファージや樹状細胞、B細胞、NK細胞といったあらゆる免疫細胞にあてはまることです。しかし、コンディショナルノックアウトマウスでは遺伝子の欠損のさせ方で表現型が異なります。例えば、Th1-Tregの解析のために、Th1-TregがFoxp3とT-betという2つのマスター転写因子を発現することを利用して、Foxp3-Cre/T-bet floxマウス(Foxp3陽性細胞でT-betを欠損させるマウス)かT-bet-Cre/Foxp3 floxマウス(その逆)が使われますが、前者は自己免疫になりませんが後者はなります。従って、コンディショナルノックアウトマウスは免疫細胞サブセットの有効な解析手法とはならないのです。
その問題を解決ために私たちは、新しい免疫細胞サブセットの解析手法であるVeDTRマウスシステムを開発しました (研究内容15 = Cell Rep. 2023; 研究内容18 = PNAS, 2024)。
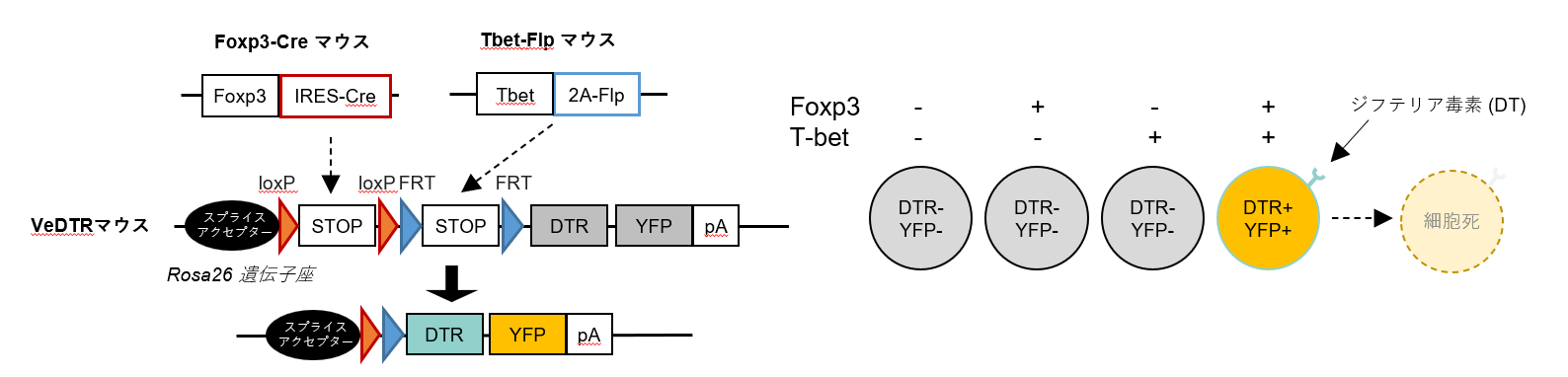
これはCre-loxPシステムとFlp-FRTシステムという2種類の組換え酵素/配列を組み合わせて、2種類の遺伝子で特徴づけられる任意の細胞を蛍光タンパク質で標識し、さらにジフテリア毒素で投与によって除去できるマウスです。これにより、Th1-TregはFoxp3-Cre/Tbet-Flp/VeDTRマウスによって特異的に標的化することができるようになりました。また、VeDTRマウスシステムをさらに拡張して、腫瘍内マクロファージ(TAM)が他の組織マクロファージと比較してArg1を排他的に発現するということを利用して、TAMだけを特異的に標的化するマウスであるCx3cr1-Cre/Arg1-Flp/VeDTRマウスを作り調べた結果、TAMがTh1-Tregの誘導に関わっていることを見つけました(研究内容19 = Science, 2024)。このように腫瘍内にはまだまだ分かっていない免疫細胞サブセットやそれら同士の未知の繋がりがありそうですし、「がん免疫」と「トキソプラズマ感染免疫」の類似性を考えると、いずれはこの免疫細胞サブセットや繋がりがトキソプラズマの感染免疫の理解の助けにもなるかもしれません。ということで、「VeDTRマウスシステムを駆使したがん免疫とその破綻の分子機構の解明」も、今や山本研の大きな研究テーマとなっています。
このVeDTRマウスシステムは、感染免疫やがん免疫の研究だけに限る必要はありません。なぜなら、調べたい免疫細胞サブセットの好きな2種類の遺伝子を選べばよいからです。これまでに私たちは、肺線維症の時にだけ出てくる特殊なTregのサブセットの解析 (Front Immunol. 2024)や肺胞マクロファージだけを標的にできるマウスの開発 (iScience, 2025) に成功しています。さらに言えば、免疫細胞に限る必要もありません。現在、シングルセル解析技術の爆発的進展によって様々な細胞系譜のサブセットが見つかっていますが、ある状態(疾患を思い浮かべてください)で、その観たい細胞が増えるか減るかといった相関関係しか言えていない状況がほとんどです。しかし、相関関係だけでは証拠力が弱く、その細胞を人為的に減らすあるいは増やすことによってその状態が変化するのか(疾患が改善するのか悪化するのか)といった因果関係にまで踏み込めていなければ表面的な解析だけに留まってしまい研究としては不十分になるばかりではなく、結果として論文もハイインパクトとはなりません。
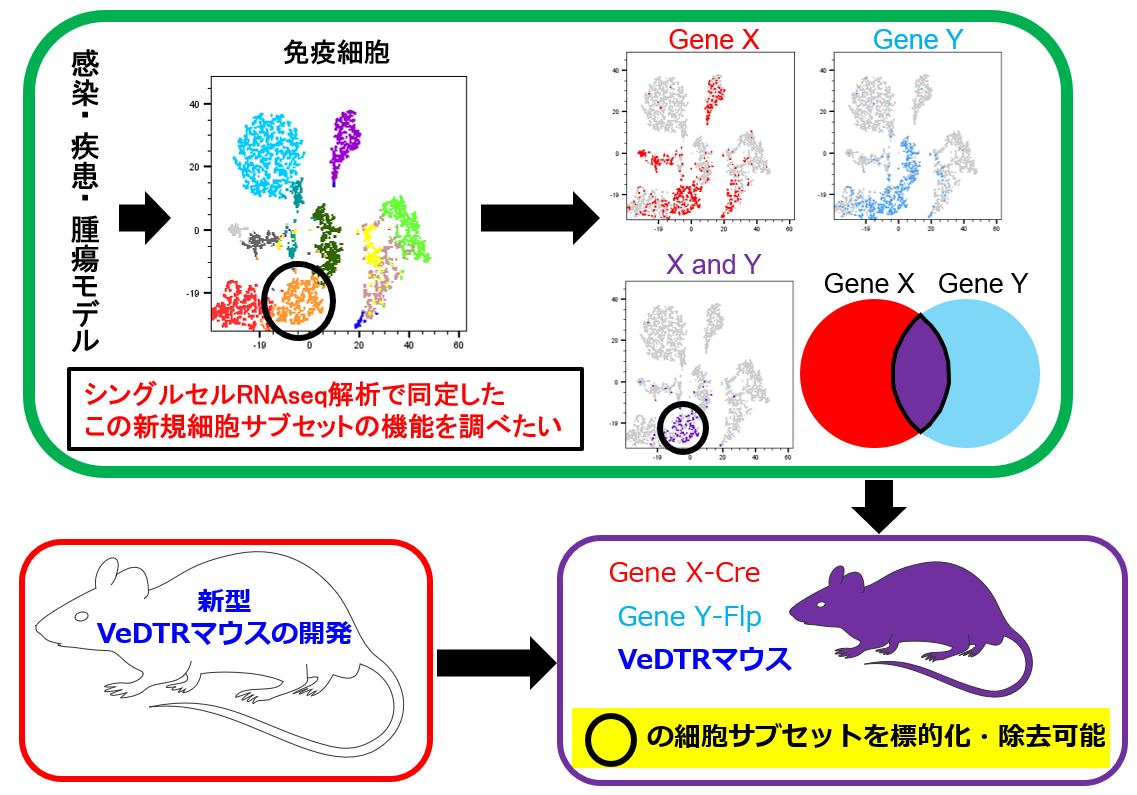
VeDTRマウスシステムは深く因果関係にまで踏み込む技術の一つとして極めて有効です。こちらの方も、「こんな免疫細胞サブセットが、こんな疾患に関わっていたのか!?」という面白い結果が、ポスドクや大学院生たちがメインプレーヤーとなって明らかになってきています。皆さんも一緒に、色々な感染・疾患・腫瘍モデルでの新しい免疫細胞サブセットを「自分で」見つけて、一緒に調べてみませんか?
最近の研究成果から
-
研究内容19
自己免疫を起こさないがん免疫活性化法を開発
「Platelet factor 4-induced Th1-Treg polarization suppresses anti-tumor immunity」by Kuratani et al. Science (2024)
詳細を見る -
研究内容18
自己免疫性の神経疾患から体を守るTh1-Treg
「IFN-γ-induced Th1-Treg polarization in inflamed brains limits exacerbation of experimental autoimmune encephalomyelitis」by Okamoto et al. PNAS (2024)
詳細を見る -
研究内容17
寄生虫最大のグループ『アピコンプレクサ』に共通する弱点を発見
「CRISPR screens identify genes essential for in vivo virulence among proteins of hyperLOPIT-unassigned subcellular localization in Toxoplasma」 by Tachibana et al. mBio (2024)
詳細を見る -
研究内容16
極東アジアのトキソプラズマの全ゲノム構造を高精細に解明
「Far-East Asian Toxoplasma isolates share ancestry with North and South/Central American recombinant lineages」by Ihara et al. Nature Communications (2024)
詳細を見る -
研究内容15
特定の免疫細胞サブセットをターゲットできる新技術
「A genetic method specifically delineates Th1-type Treg cells and their roles in tumor immunity」 by Okamoto et al. Cell Reports (2023)
詳細を見る -
研究内容14
データサイエンスで寄生虫の病原性因子を丸裸に!
「Host genetics highlights IFN-γ-dependent Toxoplasma genes encoding secreted and non-secreted virulence factors in in vivo CRISPR screens」 by Tachibana et al. Cell Reports (2023)
詳細を見る -
研究内容13
トキソプラズマの決定的病原性因子の発現機構を解明
「Toxoplasma IWS1 determines fitness in interferon-γ-activated host cells and mice by indirectly regulating ROP18 mRNA expression」by Hashizaki et al. mBio (2023)
詳細を見る -
研究内容12
抗トキソプラズマ免疫と抗ガン免疫の両方に重要な制御分子を発見
「Uncovering a novel role of PLCβ4 in selectively mediating TCR signaling in CD8+ but not CD4+ T cells」by Sasai et al. J Exp Med (2021)
詳細を見る -
研究内容11
マラリア原虫の分化の引き金となる宿主因子を同定
「CXCR4 regulates Plasmodium development in mouse and human hepatocytes」by Bando et al. J Exp Med (2019)
詳細を見る -
研究内容10
トキソプラズマ病原性因子GRA15による新規「ヒト」免疫抑制機構の解明
「Inducible Nitric Oxide Synthase Is a Key Host Factor for Toxoplasma GRA15-Dependent Disruption of the Gamma Interferon-Induced Antiparasitic Human Response」by Bando et al. mBio (2018)
詳細を見る -
研究内容09
トキソプラズマやサルモネラなどの病原体に対する免疫反応に重要な因子を同定
「Essential role for GABARAP autophagy proteins in interferon-inducible GTPase-mediated host defense」by Sasai et al. Nature Immunology (2017)
詳細を見る -
研究内容08
抗トキソプラズマ免疫反応のブレーキ役を果たす分子の同定
「p62 Plays a Specific Role in Interferon-γ-Induced Presentation of a Toxoplasma Vacuolar Antigen」by Lee et al. Cell Reports (2015)
詳細を見る -
研究内容07
抗トキソプラズマ免疫反応のブレーキ役を果たす分子の同定
「RabGDIα is a negative regulator of interferon-γ-inducible GTPase-dependent cell-autonomous immunity to Toxoplasma gondii」by Ohshima et al. PNAS (2015)
詳細を見る -
研究内容06
高病原性因子GRA6が「トロイの木馬」現象を引き起こす
「Selective and strain-specific NFAT4 activation by the Toxoplasma gondii polymorphic dense granule protein GRA6」by Ma et al. J Exp Med (2014)
詳細を見る -
研究内容05
インターフェロン依存的な抗トキソプラズマ応答におけるオートファジー蛋白質 の役割。
「Role of Mouse and Human Autophagy Proteins in IFN-γ-Induced Cell-Autonomous Response against Toxoplasma gondii」by Ohshima et al. J Immunol. (2014)
詳細を見る -
研究内容04
小胞体ストレスセンサーCREBHはスルピリンによる致死的毒性を制御する。
CREBH Determines the Sulpyrine-Induced Fatal Shock.
詳細を見る -
研究内容03
トキソプラズマ症の発病を防ぐ最重要宿主因子GBPの同定
「A cluster of interferon-γ-inducible p65 GTPases plays a critical role in host defense against Toxoplasma gondii」by Yamamoto et al. Immunity (2012)
詳細を見る -
研究内容02
エフェクター分子ROP18は宿主転写因子ATF6βの分解を誘導し免疫系を抑制する。
「ATF6β is a host cellular target of the Toxoplasma gondii virulence factor ROP18」by Yamamoto et al. J Exp Med. (2011)
詳細を見る -
研究内容01
エフェクター分子ROP16は宿主転写因子Stat3を活性化して自然免疫系を抑制する。
「A single polymorphic amino acid on Toxoplasma gondii kinase ROP16 determines the direct and strain-specific activation of Stat3」by Yamamoto et al. J Exp Med. (2009)
詳細を見る