世界初!寄生虫「トキソプラズマ」に対する免疫反応が大幅アップ!
―抗トキソプラズマ免疫反応のブレーキ役を果たす分子の同定―
RabGDIα is a negative regulator of interferon-γ-inducible GTPase-dependent cell-autonomous immunity to Toxoplasma gondii
PNAS Available online 4 Aug 2015 論文
概要
RabGDIαと呼ばれる宿主分子 が、病原性寄生虫「トキソプラズマ」に対する宿主免疫反応を抑制しており、RabGDIαの阻害によってトキソプラズマに対する免疫反応が大幅にアップすることを発見しました。
背景
トキソプラズマは寄生虫の一種です。ヒトには主にトキソプラズマが感染している肉を加熱不十分で食することによって感染し、エイズや抗癌剤治療下にある免疫不全患者に致死性の脳症や心筋炎を引き起こす他、妊婦が初感染すると流産または新生児の先天性疾患の原因になり、わが国でも症例数が増加しています。トキソプラズマに対してわれわれ宿主はインターフェロンガンマに依存した免疫反応を起こし対抗しますが、その免疫反応がどのように抑制されているのかについては全く不明でした。
研究の成果
我々は、は、2012 年に発表したトキソプラズマ寄生胞の破壊に関与するIFN-γ 誘導性タンパク質群であるGBP の一つであるGbp2 に結合するタンパク質を検索した結果、RabGDIαと呼ばれるタンパク質を免疫沈降・質量分析法で同定しました(図2A)。次にRabGDIα の生体内での役割を検討する目的で、マクロファージや好中球などで特異的にRabGDIα を欠損するマウスを作製しました。RabGDIα 欠損マウス由来のマクロファージではIFN-γ 刺激によって起こる免疫反応(トキソプラズマ原虫数の低下)が、対照群と比較して、より増強しており原虫数はさらに減少していました(図2B)。
次に対照マウス群が耐えることができず30 日程度で死亡する高力価(通常よりも多い原虫数)のトキソプラズマをRabGDIα 欠損マウスに感染させ経時的に生存率を測定した結果、RabGDIα 欠損マウス群では有意に生存期間が延長し最終な生存率も対照マウス群に比べて高いことがわかりました(図3A)。また20 日後の各臓器中のトキソプラズマの原虫数を比較した結果、RabGDIα 欠損マウス群では脳における原虫数が有意に少なかったことから、RabGDIα 欠損マウスではトキソプラズマ脳症が抑制された結果、生存率が上昇していることが示唆されました(図3B)。
次にRabGDIα 欠損細胞で、どのようなメカニズムによってIFN-γ 依存的な原虫数低下の増強が起こっているかを調べてみました。トキソプラズマの寄生胞を破壊するタンパク質群として知られているIFN-γ 誘導性GTP 分解酵素「IRG とGBP」の寄生胞への動員を検討した結果、IRG の一つであるトキソプラズマ寄生胞破壊タンパク質Irga6 とGBP の一つであるGbp2の寄生胞への動員率が、RabGDIα 欠損細胞では対照群に比較して有意に高いことを見出しました(図4A)。またGbp2 とIrga6 の関係が不明であったことから、Gbp2 欠損細胞を作製しIFN-γ 刺激によるIrga6 の寄生胞への動員率を検討したところ、Gbp2 欠損細胞では野生型細胞に比べて低かったことから、Gbp2 はIrga6 のトキソプラズマ寄生胞への動員を補助である(すなわち、Gbp2 はIrga6 にとってはアクセルの役割を果たす)ことがわかりました(図4B)。以上のことから、RabGDIα はGbp2 を介して間接的にIrga6 のトキソプラズマ寄生胞の動員を負に制御している(RabGDIα はGbp2 のブレーキ役であり、Gbp2 にブレーキがかかるために、結果としてIrga6 のトキソプラズマへの動員が抑えられる)ということが示唆されました。
最後に、RabGDIα のどの部位がRabGDIα のブレーキ機能に重要であるかを検討しました。RabGDIα のタンパク質の構造をコンピューター上で予測した結果、ポケットが存在することが分かりました(図5A)。このポケットには以前に別のグループの研究からRab(ラブ)と呼ばれるタンパク質の脂質鎖が入ることが知られていました。Gbp2 もRab と同様に脂質鎖が修飾されることから、私達の研究グループはRabGDIα のポケットにGbp2 の脂質鎖が入れないように改変することによって、RabGDIαのGbp2 に対するブレーキ機能が阻害されるのではないかと考え、ポケットに位置するM132(132 番目のメチオニン)をイソロイシンに置換したM132I 変異体を作製し、Gbp2 との結合とIFN-γ 刺激後のトキソプラズマ原虫数を検討しました。その結果、RabGDIα のM132I 変異体はGbp2 との結合能を失い(図5B)、さらに、野生型RabGDIα の過剰発現によるIFN-γ 刺激によるトキソプラズマ原虫数の増大(RabGDIα によるブレーキ反応)がRabGDIα のM132I 変異体の過剰発現では認められなかったことから、RabGDIα の脂質結合ポケットがそのブレーキ機能に重要であることがわかりました(図5C)。
以上の結果から、
① インターフェロン ガンマによって誘導されるトキソプラズマを破壊する免疫反応が、宿主からRabGDIαを取り除くことによって著しく増強され、その結果、トキソプラズマ原虫数が少なくなること
② 通常よりも多い原虫数のトキソプラズマ感染でも、RabGDIα欠損マウスは生存率が高く、致死的な脳症の程度が軽いこと
③ RabGDIαに存在する脂質結合ポケット(タンパク質の「穴」)が、そのブレーキ機能に必須であること
が明らかになりました(図6)。
今後の期待
本研究で、世界で初めて、インターフェロン ガンマによる抗トキソプラズマ免疫反応にも負の抑制制御メカニズムがあり、RabGDIα がその中心的なブレーキ機能を果たすことを報告しました。さらにこの研究では、RabGDIα の機能を阻害することによってトキソプラズマ感染に対する免疫反応が増大した結果、個体レベルでトキソプラズマ脳症発病を抑制でき生存期間・生存率が大幅に改善できることを発見しました。この知見から、インターフェロン ガンマ依存的抗トキソプラズマ免疫反応のブレーキ分子・RabGDIα の機能阻害によって、致死的なトキソプラズマ症の発病を食い止める新規の治療・予防戦略を提供できることが期待されます。
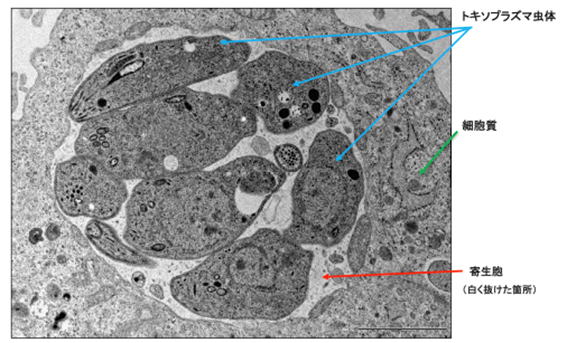
図1 「寄生胞」に包まれたトキソプラズマの電子顕微鏡写真
宿主の細胞の細胞質 (細胞の中)に感染し、寄生胞内に存在しているトキソプラズマの電子顕微鏡写真
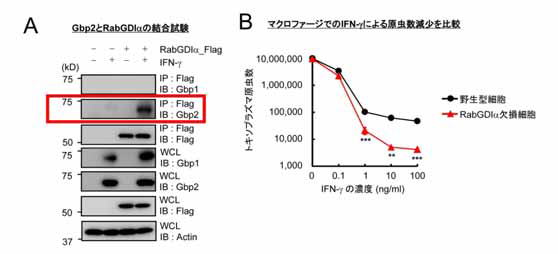
図2 Gbp2 結合タンパク質RabGDIα を欠損するとIFN-γ 依存的免疫反応が増強する
(A) RabGDIα はGbp2 とは結合するが(赤枠)、Gbp1 とは結合しないことから、RabGDIα のGbp2 の結合は特異的である。
(B) 野生型細胞に比べて、RabGDIα 欠損細胞ではIFN-γ 刺激後の原虫数が野生型細胞よりも10 倍以上少ない。
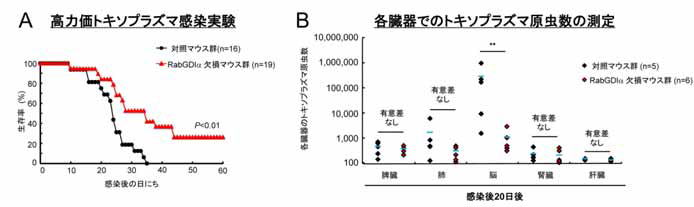
図3 RabGDIα 欠損マウスは高力価トキソプラズマ感染に耐性であり、特に脳での原虫数が少ない
(A) 野生型マウスが30 日余りで全数死亡するような高力価のトキソプラズマ感染でも、RabGDIα 欠損マウスは30%程度生き残る。
(B) 感染後20 日における各臓器の原虫数を測定した結果、脳での原虫数が少ないことから、脳症が軽度であることが分かる。
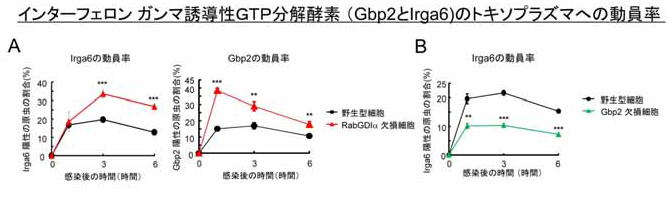
図4 RabGDIα 欠損細胞では、トキソプラズマ寄生胞を破壊するタンパク質群の動員率が増加する
(A) RabGDIα 欠損細胞は野生型細胞に比べて、Gbp2 とIrga6 の動員率が増加している。これはRabGDIα 欠損細胞において免疫反応が増強し、より原虫数が少なくなることと一致している(図2B)。
(B) Gbp2 欠損細胞ではIrga6 の動員率が低下していることから、Gbp2 はトキソプラズマ寄生胞破壊タンパク質Irga6 の働きを補助する機能があることが分かる。
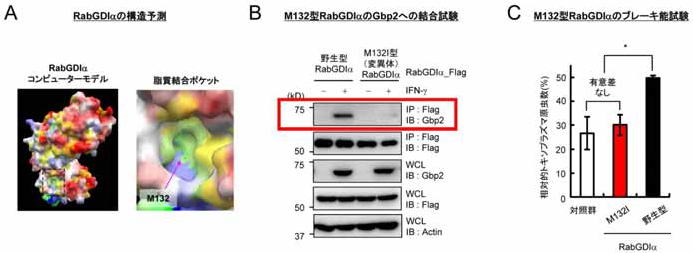
図5 RabGDIα に存在する脂質結合ポケットが、Gbp2 依存的免疫ブレーキ能に重要である
(A) コンピューター上でRabGDIα の構造を予測した結果、タンパク質に「穴」が開いていることが予測された(点線部)。
(B) 脂質結合部位に変異が入ったM132I 型RabGDIα はGbp2 と結合できなくなる(赤線部)。
(C) 野生型RabGDIα を発現させると(免疫反応にブレーキがかかるため)トキソプラズマ原虫数が増える(白棒 vs 黒棒)が、M132I 型RabGDIα をさせても原虫数は変わらない(白棒 vs 赤棒)。すなわち、M132I 型RabGDIα ではブレーキ能が失われていることが分かる。
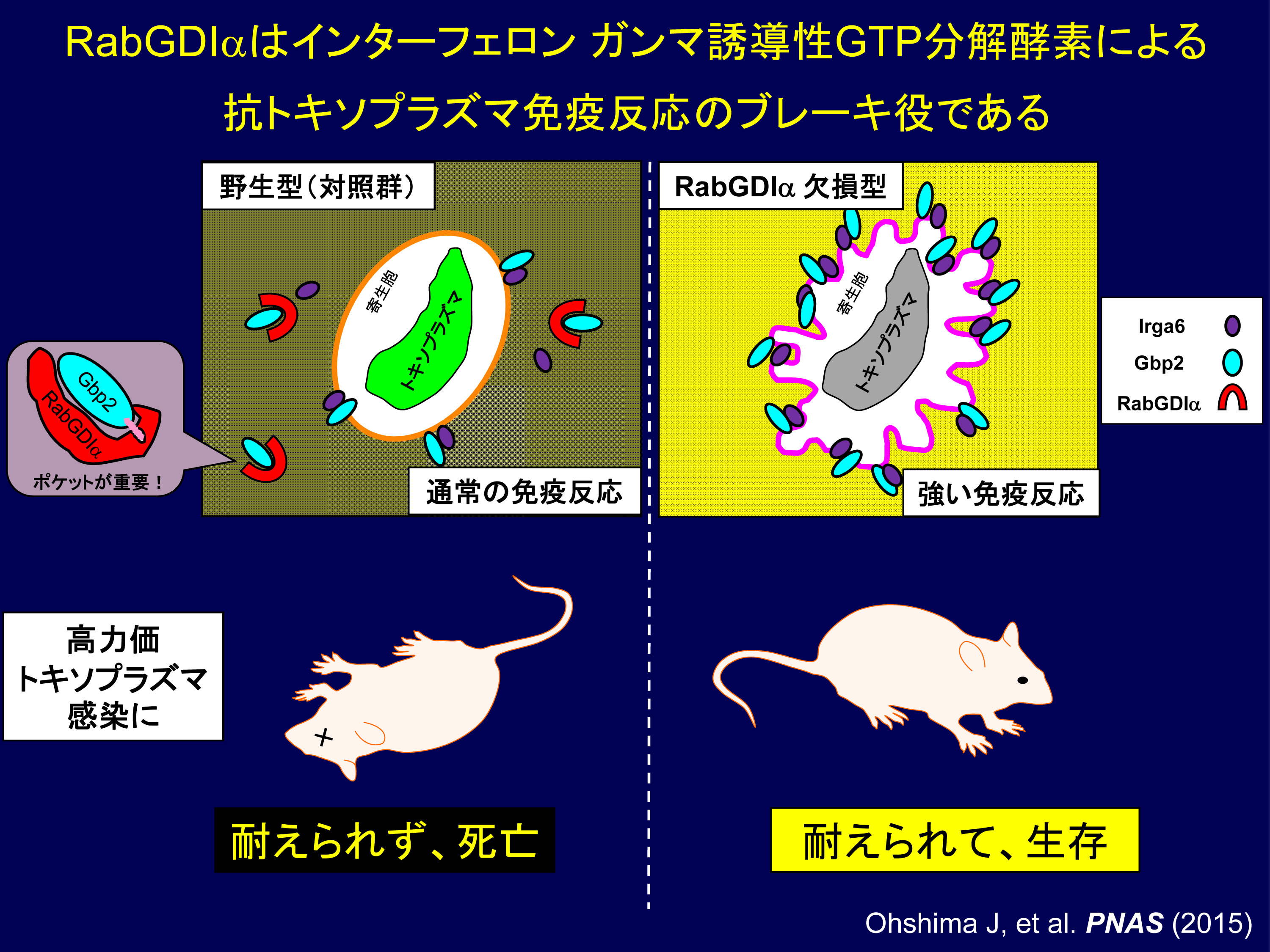
図6 RabGDIα のIFN-γ 依存的抗トキソプラズマ免疫反応でのブレーキ機能とその抑制による免疫力強化
野生型細胞で起きている通常の免疫反応ではIFN-γ 誘導性GTP 分解酵素Gbp2 にRabGDIα が脂質結合ポケットを介して結合しトキソプラズマ寄生胞への動員を妨げ、Gbp2の寄生胞破壊作用を阻害している(左上)。一方、RabGDIα 欠損細胞ではGbp2がRabGDIα に妨げられずに、さらに多く寄生胞に動員されるようになるために、通常よりも強く免疫反応が起きる(右上)。その結果、野生型マウスが全数死亡する(左下)ような高力価のトキソプラズマ感染に対しても、抗トキソプラズマ免疫ブレーキ能が解除されたRabGDIα 欠損マウスは生き延びることが可能になる(右下)
-
論文詳細12
詳細を見る -
論文詳細11
詳細を見る -
論文詳細10
詳細を見る -
論文詳細09
詳細を見る -
論文詳細08
ヒトの細胞で抗トキソプラズ免疫反応に重要な分子の同定
―宿主分子IDO1を中心とした宿主-病原体相互作用の解明―
Toxoplasma Effector TgIST Targets Host IDO1 to Antagonize the IFN-γ-Induced Anti-parasitic Response in Human Cells
詳細を見る -
論文詳細07
抗病原体分子をバランスよく配置して、免疫反応を効率化!
―GBP依存的な抗病原体免疫反応に重要な制御因子Gate-16の同定―
Essential role for GABARAP autophagy proteins in interferon-inducible GTPase-mediated host defense
詳細を見る -
論文詳細06
実験的トキソプラズマワクチンがどのように効くかを解明!
―宿主タンパク質 p62を標的とした新たなワクチンの開発に前進―
p62 Plays a Specific Role in Interferon-γ-Induced Presentation of a Toxoplasma Vacuolar Antigen
詳細を見る -
論文詳細05
世界初!寄生虫「トキソプラズマ」に対する免疫反応が大幅アップ!
―抗トキソプラズマ免疫反応のブレーキ役を果たす分子の同定―
RabGDIα is a negative regulator of interferon-γ-inducible GTPase-dependent cell-autonomous immunity to Toxoplasma gondii
詳細を見る -
論文詳細04
寄生虫「トキソプラズマ」は、どのように宿主の身体を乗っ取るか?
―高病原性因子 高病原性因子 GRA6「トロイの木馬」現象を引き起こす ―
Selective and strain-specific NFAT4 activation by the Toxoplasma gondii polymorphic dense granule protein GRA6.
詳細を見る -
論文詳細03
インターフェロン-ガンマ依存的な抗トキソプラズマ応答におけるオートファジー蛋白質の役割
Role of Mouse and Human Autophagy Proteins in IFN-γ-Induced Cell-Autonomous Responses against Toxoplasma gondii.
詳細を見る -
論文詳細02
CREBHによるスルピリンの副作用誘導機構
CREBHはスルピリンによって誘導される致死的ショックの重症度を決定する
CREBH Determines the Severity of Sulpyrine-induced Fatal Shock
詳細を見る -
論文詳細01
トキソプラズマ症の発病を防ぐ最重要宿主防御因子GBPの同定
インターフェロン誘導性タンパクGBPは寄生虫「トキソプラズマ」を破壊する
A Cluster of Interferon-γ-Inducible p65 GTPases Plays a Critical Role in Host Defense against Toxoplasma gondii
詳細を見る