CREBHによるスルピリンの副作用誘導機構
CREBHはスルピリンによって誘導される致死的ショックの重症度を決定する
CREBH Determines the Severity of Sulpyrine-induced Fatal Shock
PLoS One Available online 7 Feb 2013 論文
概要
今回の報告で我々は、CREBHはスルピリンにより活性化され、CYP2Bの転写における正の制御因子として働くことにより、スルピリンショックの発現に関与することを明らかにしました。
背景
ピラゾロン系の解熱鎮痛薬であるスルピリンはその解熱鎮痛効果の高さから、世界中の多くの国々で解熱鎮痛の際の第一選択薬として広く使用されていますが、その重篤な副作用としてショック症例が報告されています。
研究の成果
CREBHは肝臓に高発現している小胞体膜貫通型転写因子です。我々はCREBHが肝臓の主な働きの1つである薬物解毒作用にCREBHが関与しているのではないかと予想し、CREBH欠損マウスを用いてその作用を検討しました。
我々は、CREBHの機能を解析するためにCREBH欠損マウスを作成しました。そして、野生型マウス、CREBH欠損マウスにスルピリンを投与したところ、CREBH欠損マウスは野生型マウスに比べて耐性を示しました。一方で同じく解熱鎮痛薬の一種であるアセトアミノフェンの投与では両群の生存率に有意な差は見られませんでした(図1A)。次に、スルピリンの生体内代謝産物である4-アミノアンチピリンの血中濃度をHPLC法により測定しました。その結果、CREBH欠損マウスでは4-アミノアンチピリンの血中濃度は野生型マウスに比べて低くなっていました(図1B)。また、別実験により4-アミノアンチピリンがスルピリン投与時のマウスの死亡原因となる物質であることを明らかにしました。(論文参照)
次にCREBHがスルピリンショックの原因遺伝子であるかを確認するためにCREBH欠損マウスにCREBHをin vivoトランスフェクションし、スルピリンに対する感受性を解析しました。CREBHを戻したCREBH欠損マウスはスルピリン投与時の4-アミノアンチピリンの血中濃度が上昇し、スルピリン耐性が失われたことにより、CREBHがスルピリンショック発現の原因遺伝子であることが明らかになりました(図2)。
そこで、肝臓のサンプルを用いてCREBHによって発現を制御されている遺伝子をマイクロアレイ法により解析しました。その結果、スルピリンの代謝に関与していると報告されている薬物代謝酵素であるCYP2Bファミリー遺伝子の発現がスルピリン投与時に、CREBH欠損マウスは野生型マウスに比べて低いことが判明しました。このことから、CYP2Bがスルピリンに対する感受性に関与していることが予想されました。CYP2Bがスルピリンショックの原因遺伝子であるかを検討するため、CREBH欠損マウスにCYP2B6をin vivoトランスフェクションし、スルピリンに対する感受性を解析しました。CYP2B6を発現させたCREBH欠損マウスはスルピリン投与時の4-アミノアンチピリンの血中濃度が上昇し、スルピリン耐性が失われたことから、CYP2B6がスルピリンショック発現の原因遺伝子であることが明らかになりました(図3)。
また、CREBHを発現させた293T細胞をスルピリン刺激するとCREBHの活性化、及び核移行が観察されました。以上より、スルピリンがERストレスを誘導してCREBHを活性化することを確認しました(図4)。
まとめますと、CREBHはスルピリンにより活性化され、CYP2Bの転写における正の制御因子として働きます。野生型マウスにおきましてはスルピリン投与時、CYP2Bが強く誘導されてくるため、スルピリンの代謝物である4-アミノアンチピリンの血中濃度が高くなり、その多くは死亡してしまいます。対して、CREBH欠損マウスにおきましては4-アミノアンチピリンの血中濃度が野生型マウスに比べて低いためにその多くは死亡を免れることになります(図5)。
今後の期待
我々の研究により、肝臓で高発現している転写因子CREBHがスルピリンの代謝に関与しており、その代謝産物がマウスに薬害をもたらすことが明らかになりました。CREBHが薬害発現の原因因子でありますので、RNA干渉法を用いて一時的にCREBHの発現を抑制したマウスにスルピリンを投与しますと、耐性を獲得することわかりました。(論文参照)このことから、今後ヒトにおいてもCREBHをターゲットとした、薬害の予防的治療の応用に本研究が貢献することを期待しております。
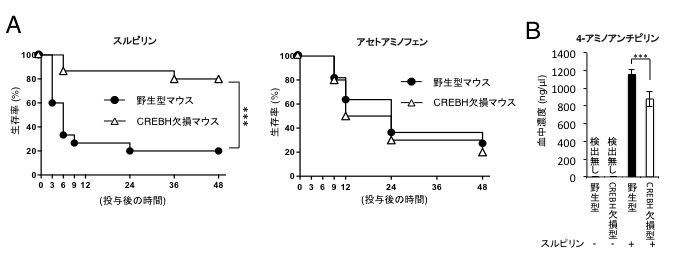
図1 CREBH欠損したマウスはスルピリン投与時に4-アミノアンチピリンの血中濃度の上昇が抑えられ、スルピリンに耐性を示す
(A)野生型及びCREBH欠損マウスに解熱鎮痛薬であるスルピリン又はアセトアミノフェンを投与した結果、CREBH欠損マウスはスルピリン投与に対して耐性を示すことが明らかとなった。しかし、アセトアミノフェン投与時には両群の生存率に有意な差は認められなかった。
(B)スルピリン投与後にスルピリンの代謝産物である4-アミノアンチピリンの血中濃度をHPLC解析により測定すると野生型マウスではCREBH欠損マウスに比べて有意に高い値を示した。
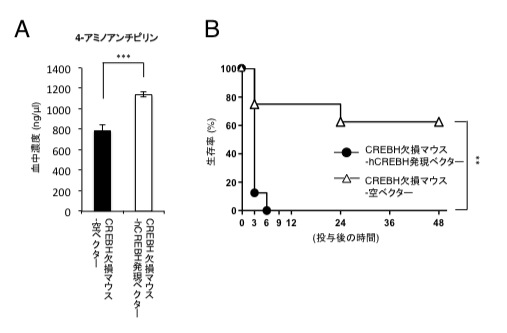
図2 CREBH欠損マウスにCREBHを戻すと、スルピリン投与後の4-アミノアンチピリンの血中濃度が高くなり、スルピリンに対する感受性が戻る
(A)CREBH欠損マウスにCREBHをin vivo トランスフェクションして、スルピリンを投与すると、対照群に比べて4-アミノアンチピリンの血中濃度が有意に高くなる。
(B)また、CREBH in vivo トランスフェクションマウスは対照群に比べてスルピリンに対する感受性も上昇する。
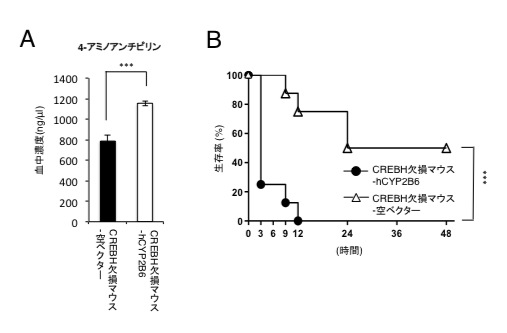
図3 CREBH欠損マウスにCYP2B6を発現させると、スルピリン投与後の4-アミノアンチピリンの血中濃度が高くなり、スルピリンに対する感受性が上昇する
(A)CREBH欠損マウスにCYP2B6をin vivo トランスフェクションして、スルピリンを投与すると、対照群に比べて4-アミノアンチピリンの血中濃度が有意に高くなる。
(B)また、CYP2B6 in vivo トランスフェクションマウスは対照群に比べてスルピリンに対する感受性も上昇する。
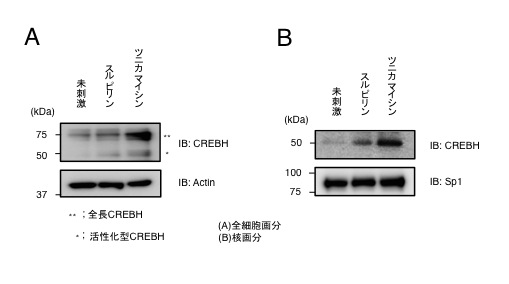
図4 CREBHはスルピリン刺激により活性化し核移行する
(A)293T細胞にCREBHを発現させて、スルピリン刺激すると活性化型のCREBHが確認できる。
(B)また、核画分を単離したサンプルを用いると、スルピリン刺激によりCREBHが核移行していることが確認される。
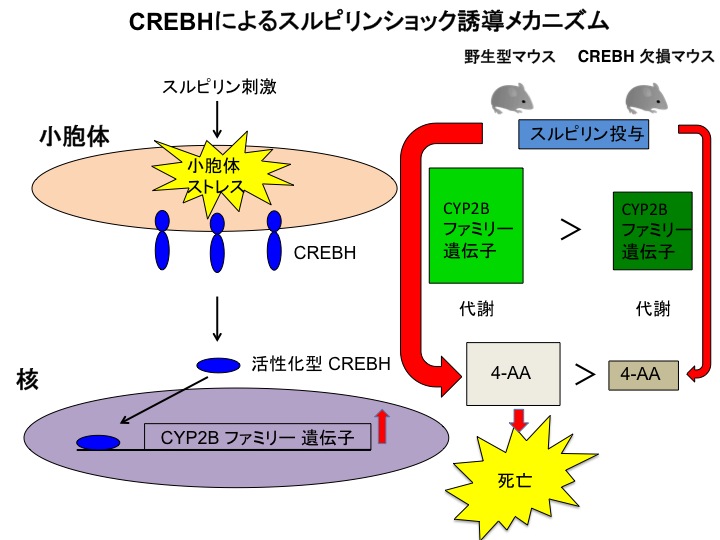
図5 今回明らかとなったCREBHによるスルピリンショック誘導メカニズム
スルピリンによって活性化されたCREBHはCYP2Bを誘導して4-アミノアンチピリンの血中濃度を上昇させる。スルピリン投与時、野生型マウスではCYP2Bが強く誘導されるため4-アミノアンチピリンの血中濃度が高くなる。しかし、CREBH欠損マウスでは4-アミノアンチピリンの血中濃度の上昇が抑えられるため、スルピリンに耐性を示す。
-
論文詳細12
詳細を見る -
論文詳細11
詳細を見る -
論文詳細10
詳細を見る -
論文詳細09
詳細を見る -
論文詳細08
ヒトの細胞で抗トキソプラズ免疫反応に重要な分子の同定
―宿主分子IDO1を中心とした宿主-病原体相互作用の解明―
Toxoplasma Effector TgIST Targets Host IDO1 to Antagonize the IFN-γ-Induced Anti-parasitic Response in Human Cells
詳細を見る -
論文詳細07
抗病原体分子をバランスよく配置して、免疫反応を効率化!
―GBP依存的な抗病原体免疫反応に重要な制御因子Gate-16の同定―
Essential role for GABARAP autophagy proteins in interferon-inducible GTPase-mediated host defense
詳細を見る -
論文詳細06
実験的トキソプラズマワクチンがどのように効くかを解明!
―宿主タンパク質 p62を標的とした新たなワクチンの開発に前進―
p62 Plays a Specific Role in Interferon-γ-Induced Presentation of a Toxoplasma Vacuolar Antigen
詳細を見る -
論文詳細05
世界初!寄生虫「トキソプラズマ」に対する免疫反応が大幅アップ!
―抗トキソプラズマ免疫反応のブレーキ役を果たす分子の同定―
RabGDIα is a negative regulator of interferon-γ-inducible GTPase-dependent cell-autonomous immunity to Toxoplasma gondii
詳細を見る -
論文詳細04
寄生虫「トキソプラズマ」は、どのように宿主の身体を乗っ取るか?
―高病原性因子 高病原性因子 GRA6「トロイの木馬」現象を引き起こす ―
Selective and strain-specific NFAT4 activation by the Toxoplasma gondii polymorphic dense granule protein GRA6.
詳細を見る -
論文詳細03
インターフェロン-ガンマ依存的な抗トキソプラズマ応答におけるオートファジー蛋白質の役割
Role of Mouse and Human Autophagy Proteins in IFN-γ-Induced Cell-Autonomous Responses against Toxoplasma gondii.
詳細を見る -
論文詳細02
CREBHによるスルピリンの副作用誘導機構
CREBHはスルピリンによって誘導される致死的ショックの重症度を決定する
CREBH Determines the Severity of Sulpyrine-induced Fatal Shock
詳細を見る -
論文詳細01
トキソプラズマ症の発病を防ぐ最重要宿主防御因子GBPの同定
インターフェロン誘導性タンパクGBPは寄生虫「トキソプラズマ」を破壊する
A Cluster of Interferon-γ-Inducible p65 GTPases Plays a Critical Role in Host Defense against Toxoplasma gondii
詳細を見る