トキソプラズマ症の発病を防ぐ最重要宿主防御因子GBPの同定
インターフェロン誘導性タンパクGBPは寄生虫「トキソプラズマ」を破壊する
A Cluster of Interferon-γ-Inducible p65 GTPases Plays a Critical Role in Host Defense against Toxoplasma gondii
Immunity Available online 12 July 2012 論文
概要
今回の報告で我々は、インターフェロンにより誘導されるタンパク質であるGBP(p65 GTP分解酵素)が寄生虫「トキソプラズマ」を破壊することでトキソプラズマ症の発病を抑制している宿主防御因子であることを明らかにしました。
背景
寄生虫「トキソプラズマ」はエイズや抗癌剤投与下にある免疫不全患者に致死性のトキソプラズマ症や妊婦に流産と新生児に水頭症を引き起こす先天性疾患の原因病原体です。我々ヒトを含む宿主はインターフェロンと呼ばれる分子を出すことでトキソプラズマ症の発病を抑えていること四半世紀前から分かっていましたが、インターフェロンが具体的にどのようにしてトキソプラズマを破壊するのか、そのメカニズムは不明でした。
研究の成果
我々は、IFNγがマクロファージや線維芽細胞などの自然免疫担当細胞に作用して、約2000種類のエフェクター分子群の遺伝子発現を誘導することに着目しました。中にはトキソプラズマの寄生胞の周辺に集まってくるGBP(p65 GTP分解酵素)と呼ばれる13個のファミリー分子群から形成されるエフェクター分子群があり、宿主の抗トキソプラズマ免疫応答に何らかの役割を果たしていることが考えられました。通常、ある特定の遺伝子の役割を調べたいという場合には一つの遺伝子を欠損させたマウスを作成して検討しますが、GBPの場合はそれぞれの遺伝子の相同性が非常に高く(つまり、よく似ているため)、一つの遺伝子を欠損させても非常に良く似た別のGBPファミリー分子がその機能を補う(相補する)ことが予想されました。そこで当研究グループではGBPファミリー分子が6個と7個に分かれて異なる染色体上の非常に狭い領域に隣り合って存在することを利用して、染色体工学的手法を用いて3番染色体上に存在する全てのGBP(6個)のGBPファミリー分子を欠損するマウス(GBPchr3欠損マウス)の作製し解析しました。
GBPchr3欠損マウスと野生型マウスにトキソプラズマを感染させ生存率を測定した所、GBPchr3欠損マウスはトキソプラズマ感染に対して非常に弱くなっていることが分かりました(図1A)。また感染マウス内でのトキソプラズマの感染拡大を、トキソプラズマから出る発光を指標に生体イメージング装置を使って検討したところ、GBPchr3欠損マウス内では野生型マウスと比べて劇的にトキソプラズマが増殖していることが分かりました(図1B)。次にトキソプラズマが生体内で感染している細胞であるマクロファージと呼ばれる自然免疫細胞を単離して、トキソプラズマを感染させその増殖を検討しました。IFNγで野生型マクロファージを処理すると濃度依存的にトキソプラズマの増殖が抑制されますが、GBPchr3欠損マクロファージではIFNγによるトキソプラズマの増殖を野生型細胞と比較して抑制できないことを見出しました(図1C)。このことから、IFNγによって誘導されるGBPchr3は自然免疫細胞マクロファージ内でトキソプラズマ増殖を妨げることが、生体レベルでのトキソプラズマに対する感染防御反応に重要であることが分かりました。
では、GBPを欠損したマクロファージでは何故トキソプラズマの増殖を抑制できないのでしょうか?その問題を解決するために研究グループは電子顕微鏡を使って、感染細胞内でのトキソプラズマの状態を検討しました。その結果、IFNγで刺激した野生型マクロファージ内ではトキソプラズマの寄生胞の膜が激しく波打ち、その構造が著しく破壊されていました(図2A)。一方、GBPchr3欠損マクロファージ内ではIFNγ処理をしてもそのような寄生胞膜の構造変化は認められませんでした(図2B)。このことから、GBPはマクロファージ内でトキソプラズマの寄生胞の膜構造を破壊する機能があることが分かりました。
ではどのようにしてGBPはトキソプラズマの寄生胞膜を破壊することができるのでしょうか?以前から寄生胞膜の破壊についての機能が示唆されていたGBPとは別のファミリー分子群であるp47 GTP分解酵素(IRG)の動態について、野生型及びGBPchr3欠損マクロファージで比較しました。すると、野生型細胞ではIRGがトキソプラズマに蓄積するのに対して、GBPchr3欠損マクロファージではIRGの蓄積が著しく減少していることが分かりました(図3A)。またGBPとIRGの局在について野生型マクロファージ内で検討したところどちらもトキソプラズマに蓄積し、さらにGBPはIRGに結合していることも分かりました(図3B)。これらのことから、GBPはIRGをトキソプラズマに蓄積させることでその寄生胞膜を破壊し増殖を阻害していることが示唆されました(図4)。
今後の期待
今回の研究により、IFNγによって誘導される抗トキソプラズマ感染防御機構にGBPが重要な役割を果たしていることを明らかにしました。このことから、人為的にGBPの機能を高めることにより、我が国で症例報告が急増しているトキソプラズマ症に対する新たな治療戦略を提供できることが期待できます。
寄生胞はトキソプラズマに限らずマラリア原虫においても形成されることを考えると、GBPがマラリア原虫感染防御に関与する可能性は非常に高く、マラリア症の発病におけるGBPの役割の解明は最も重要な今後の研究課題です。またGBPは様々な癌において高い発現が認められることが多数報告されており、感染下ではない異常な状態でのGBPの存在が引き起こす疾患の病理機構の解明に、研究グループが染色体工学により作り出したGBP欠損マウスが非常に有用であると考えられます。
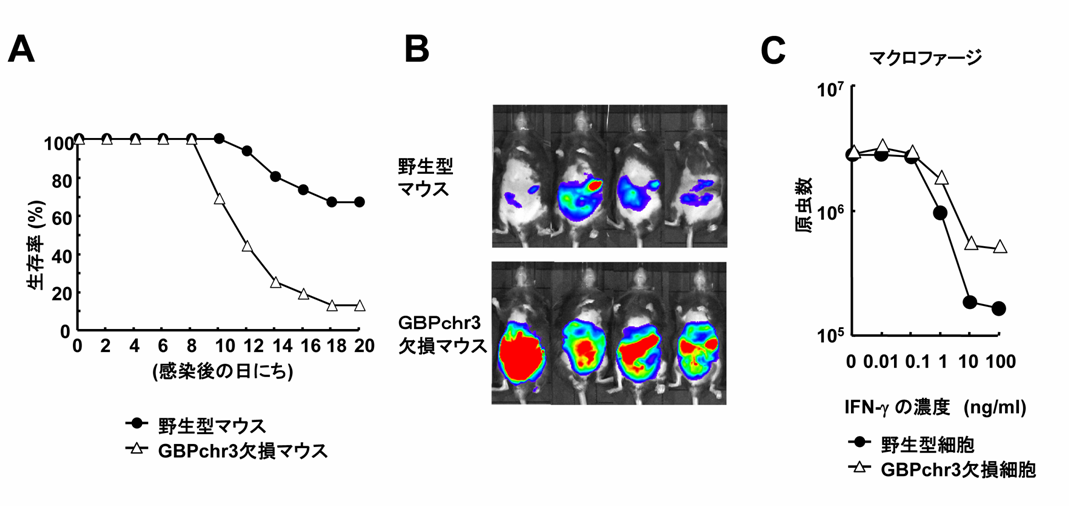
図1 GBPchr3を欠損したマウス及び細胞はトキソプラズマ感染に弱くなる
(A)野生型及びGBPchr3欠損マウスにトキソプラズマを感染させ生存率を測定した結果、GBPchr3欠損マウスはトキソプラズマ感染に非常に感受性が高まることが明らかとなった。
(B)発光するトキソプラズマをマウスに感染させ、生体イメージング装置でトキソプラズマの動態を観察したところ、GBPchr3欠損マウス内でトキソプラズマがより多く増殖した。
(C)野生型マクロファージをIFNγで刺激すると濃度依存的にトキソプラズマの数が減少するが、GBPchr3欠損マクロファージでは野生型に比べて原虫数の数が多かったことから、GBPchr3の欠損によりIFNγ依存的な増殖抑制に障害が出ることが示唆された。
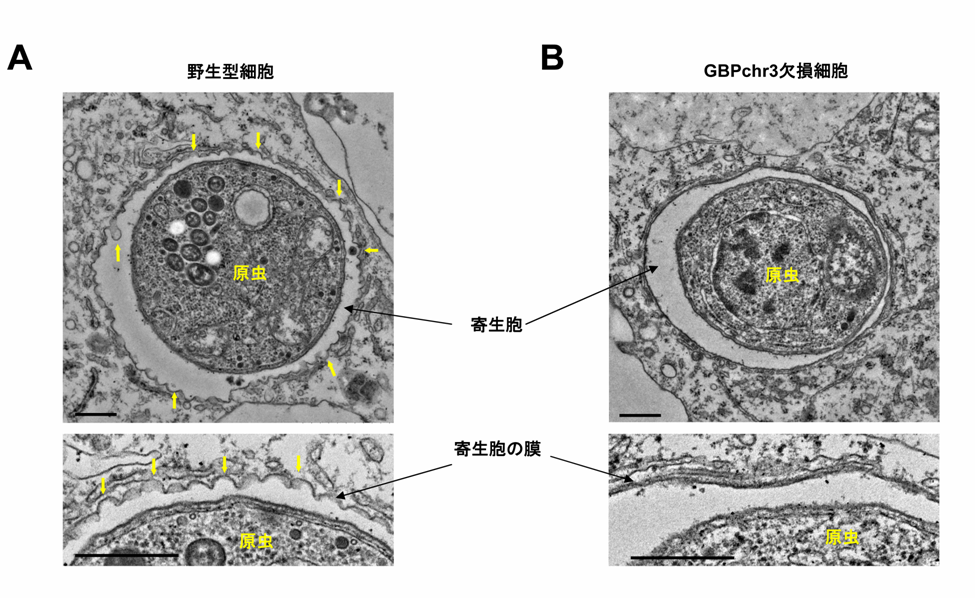
図2 GBPchr3を欠損した細胞では寄生胞膜の構造変化が認められない
(A)野生型
(B)GBPchr3欠損マクロファージにおける寄生胞内のトキソプラズマの電子顕微鏡像。
野生型細胞では寄生胞の膜が激しく波打っているのに対し、GBPchr3欠損細胞ではそのような変化は認められない。
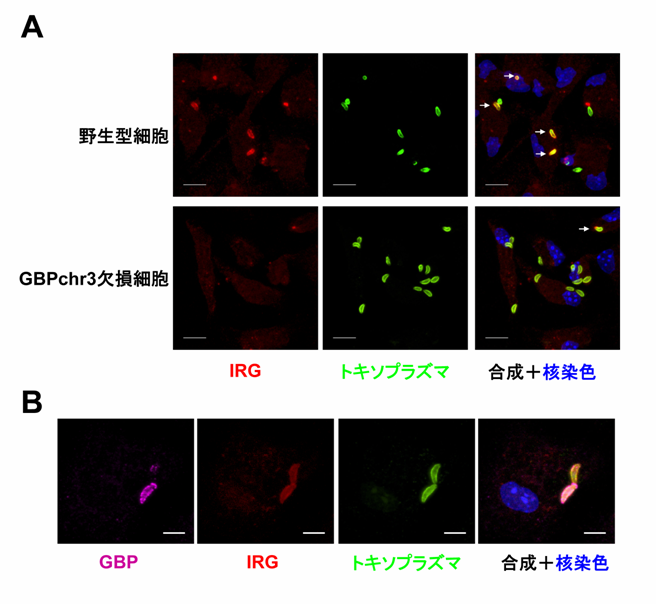
図3 GBPchr3を欠損した細胞ではIRGのトキソプラズマへの蓄積が低下している
(A)IRGのトキソプラズマへの蓄積を比較した所、野生型細胞に比べてGBPchr3欠損細胞ではIRGとトキソプラズマが共局在している像が認められない。
(B)野生型細胞においてGBP、IRGとトキソプラズマは共局在をすることからGBPとIRGは非常に近い所に存在することが示唆された。
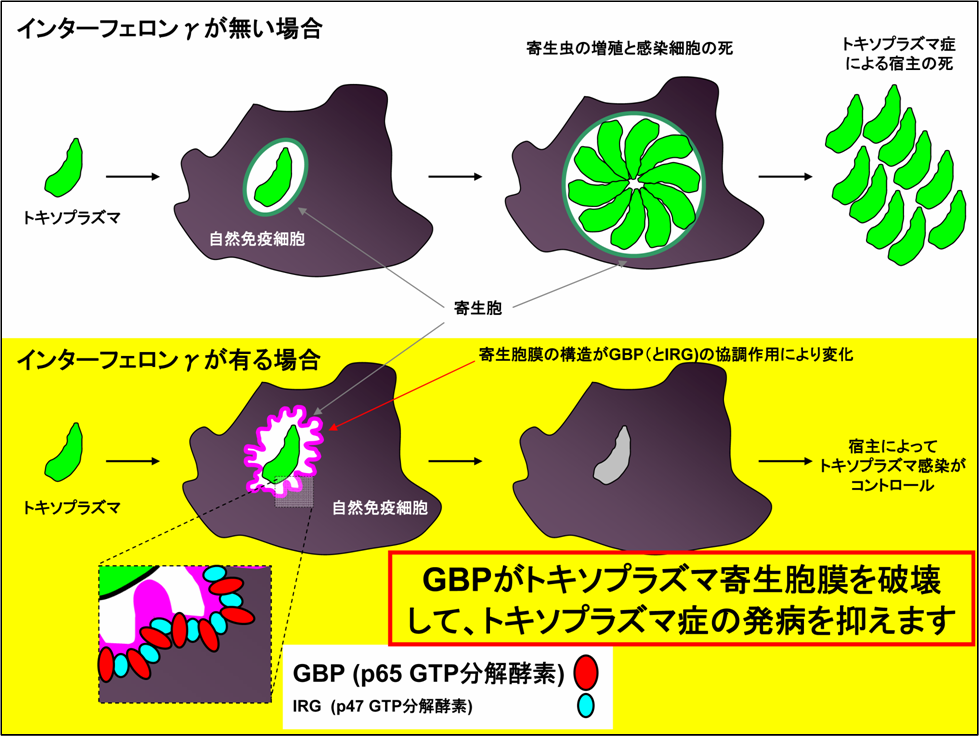
図4 今回明らかとなったインターフェロン誘導性タンパクGBPを介する抗トキソプラズマ感染防御機構
IFNγが無い場合トキソプラズマは感染細胞内の寄生胞内で増殖し、その結果感染細胞はトキソプラズマによって殺され、最終的には宿主がトキソプラズマ症により死亡する。
一方、IFNγ存在下ではGBPが誘導され寄生胞膜にIRGと共に蓄積することで寄生胞膜構造を破壊し、トキソプラズマは増殖することができなくなる。
-
論文詳細12
詳細を見る -
論文詳細11
詳細を見る -
論文詳細10
詳細を見る -
論文詳細09
詳細を見る -
論文詳細08
ヒトの細胞で抗トキソプラズ免疫反応に重要な分子の同定
―宿主分子IDO1を中心とした宿主-病原体相互作用の解明―
Toxoplasma Effector TgIST Targets Host IDO1 to Antagonize the IFN-γ-Induced Anti-parasitic Response in Human Cells
詳細を見る -
論文詳細07
抗病原体分子をバランスよく配置して、免疫反応を効率化!
―GBP依存的な抗病原体免疫反応に重要な制御因子Gate-16の同定―
Essential role for GABARAP autophagy proteins in interferon-inducible GTPase-mediated host defense
詳細を見る -
論文詳細06
実験的トキソプラズマワクチンがどのように効くかを解明!
―宿主タンパク質 p62を標的とした新たなワクチンの開発に前進―
p62 Plays a Specific Role in Interferon-γ-Induced Presentation of a Toxoplasma Vacuolar Antigen
詳細を見る -
論文詳細05
世界初!寄生虫「トキソプラズマ」に対する免疫反応が大幅アップ!
―抗トキソプラズマ免疫反応のブレーキ役を果たす分子の同定―
RabGDIα is a negative regulator of interferon-γ-inducible GTPase-dependent cell-autonomous immunity to Toxoplasma gondii
詳細を見る -
論文詳細04
寄生虫「トキソプラズマ」は、どのように宿主の身体を乗っ取るか?
―高病原性因子 高病原性因子 GRA6「トロイの木馬」現象を引き起こす ―
Selective and strain-specific NFAT4 activation by the Toxoplasma gondii polymorphic dense granule protein GRA6.
詳細を見る -
論文詳細03
インターフェロン-ガンマ依存的な抗トキソプラズマ応答におけるオートファジー蛋白質の役割
Role of Mouse and Human Autophagy Proteins in IFN-γ-Induced Cell-Autonomous Responses against Toxoplasma gondii.
詳細を見る -
論文詳細02
CREBHによるスルピリンの副作用誘導機構
CREBHはスルピリンによって誘導される致死的ショックの重症度を決定する
CREBH Determines the Severity of Sulpyrine-induced Fatal Shock
詳細を見る -
論文詳細01
トキソプラズマ症の発病を防ぐ最重要宿主防御因子GBPの同定
インターフェロン誘導性タンパクGBPは寄生虫「トキソプラズマ」を破壊する
A Cluster of Interferon-γ-Inducible p65 GTPases Plays a Critical Role in Host Defense against Toxoplasma gondii
詳細を見る