寄生虫「トキソプラズマ」は、どのように宿主の身体を乗っ取るか?
―高病原性因子 高病原性因子 GRA6「トロイの木馬」現象を引き起こす ―
Selective and strain-specific NFAT4 activation by the Toxoplasma gondii polymorphic dense granule protein GRA6.
Journal of Experimental Medicine Available online 16 sep 2014 論文
概要
寄生虫「トキソプラズマ」の病原性因子GRA6が宿主の免疫制御分子であるNFAT4を活性化して宿主自然免疫細胞を強制的に利用(ハイジャック)することが、トキソプラズマ症の重症化の一つの理由であることをつきとめました。
背景
トキソプラズマは寄生虫の一種で、エイズや抗癌剤治療下にある免疫不全患者に致死性の脳症や心筋炎を引き起こします。十分加熱されていない肉(レアのステーキや生ハムでも)から感染する以外に猫のふんから感染することも確認されています。妊婦が感染すると流産、新生児の水頭症など先天性疾患の原因になり、わが国でも報告が増加していますが、トキソプラズマが持つどの病原性因子が局所から全身性に感染拡大に関与するかは全く不明でした。
研究の成果
我々はトキソプラズマが感染細胞中に濃縮顆粒(デンスグラニュール)から分泌する分子群(GRAファミリータンパク質群)に着目しました(図1、図2)。まずGRAタンパク質を個別に哺乳動物細胞内で強制的に発現させ、どのような宿主転写因子活性化経路が反応するかを検討しました。その結果、GRAファミリータンパク質群の中でGRA6が宿主転写因子であるNFAT依存的なレポーターを非常に強く活性化することを見出しました(図2A)。次に、NFAT1からNFAT5まで5種類存在するNFATの中でどのNFATを活性化するのかを検討した結果、NFAT4の発現を抑制した哺乳動物細胞ではGRA6過剰発現によるNFAT依存的レポーターの活性化が低下したことから、GRA6はNFAT4を選択的に活性化することを同定しました(図2B)。またGRA6を欠損するトキソプラズマを相同組み換えによるジーンターゲティング法により作成し、トキソプラズマ感染による細胞でのNFAT4の活性化がGRA6に依存しているかを検討した結果、GRA6欠損トキソプラズマ感染ではNFAT4の核移行(NFAT4の活性化の指標)が認められませんでした。このことから、寄生虫感染という生理的条件下においてもGRA6がNFAT4を活性化する重要な因子であることが突き止められました(図2C)。
では、GRA6はトキソプラズマ感染における病原性にどのような役割を持っているのでしょうか?それを検討するために、野生型トキソプラズマとGRA6欠損トキソプラズマをマウスの足蹠(そくせき;footpad)に感染させ、生体イメージング法によりマウスの全身への感染拡大を比較検討しました。その結果、野生型トキソプラズマに比べてGRA6欠損トキソプラズマは足蹠からの感染拡大が遅延していました(図3A)。さらにGRA6欠損トキソプラズマ感染マウス群の生存期間は野生型トキソプラズマ感染マウス群よりも有意に延長していたことから、GRA6は感染局所から全身への感染拡大に重要な役割を果たす病原性因子であることが分かりました(図3B)。
次に感染局所である足蹠で野生型トキソプラズマが病原性因子GRA6を介して宿主転写因子NFAT4を活性化する理由について検討してみました。まず野生型トキソプラズマが感染した膝のリンパ節では、トキソプラズマに感染している細胞のうち、50%以上の細胞がCD11b陽性の自然免疫細胞でした。また野生型トキソプラズマが感染した足蹠においては自然免疫細胞である好中球(CD11b陽性 Ly6G陽性細胞)が多数存在していましたが、GRA6欠損トキソプラズマが感染した足蹠では好中球の数が顕著に減少していました。さらに野生型トキソプラズマが感染した足蹠に比べて、GRA6欠損トキソプラズマが感染した足蹠では非常に強い好中球遊走能を有する液性因子であるケモカイン(Cxcl2やCcl2)の発現レベルが低いことが判明しました。
最後に、GRA6依存的な足蹠への好中球の遊走と好中球遊走ケモカイン群の発現がNFAT4に依存しているかどうかを検討する目的で、NFAT4欠損マウスをCRISPR/Cas9ヌクレアーゼを使用したゲノム編集法により作製し、野生型トキソプラズマを感染させました。その結果、野生型マウスにおいて認められたトキソプラズマ感染による足蹠への好中球への遊走とケモカイン群(Cxcl2とCcl2)の発現が、NFAT4欠損マウス群においては有意に低下していました(図4A、B)。さらにNFAT4欠損マウスは野生型トキソプラズマ感染に対して、野生型マウスに比べて、有意に生存期間が延びました(図4C)。これは、GRA6欠損トキソプラズマを野生型マウスに感染させた時に認められる生存期間の延長と非常に良く似ています。
さらに、トキソプラズマには高病原性のものと低病原性のものが存在しますが、高病原性のトキソプラズマが有するGRA6は、低病原性トキソプラズマのGRA6に比べてNFAT4の活性能が高いことも明らかにしました。
以上の結果から、
①トキソプラズマが宿主細胞内に分泌するGRA6が宿主重要転写因子であるNFAT4を非常に強く活性化する能力を有すること
②GRA6によって活性化されたNFAT4が、強力な免疫細胞遊走能を有するケモカインを感染局所でさらに誘導し、免疫細胞である好中球が感染局所に呼び寄せられ、トキソプラズマがその好中球に感染すること
③好中球をまるで「トロイの木馬」のように利用して、トキソプラズマが局所から全身性に感染拡大していること が明らかになりました(図5)。
今後の期待
本研究では、トキソプラズマが宿主細胞内に分泌する病原性因子GRA6を使用して、宿主免疫機構を「ハイジャック」することにより病原性を最大化するメカニズムを解明したのと同時に、宿主因子NFAT4の活性化がトキソプラズマの病原性発揮に重要であることを示しました。この点に関して、転写因子NFAT4を含めNFATの活性化を阻害する薬剤は、すでに別の用途で治療薬として広く世の中で使用されています。従って、トキソプラズマの感染初期において、全身性にトキソプラズマの伝播を阻止する目的でNFAT活性化阻害薬が使用されることにより、トキソプラズマ症の発病を食い止める新規の治療・予防戦略を提供できることが期待されます。
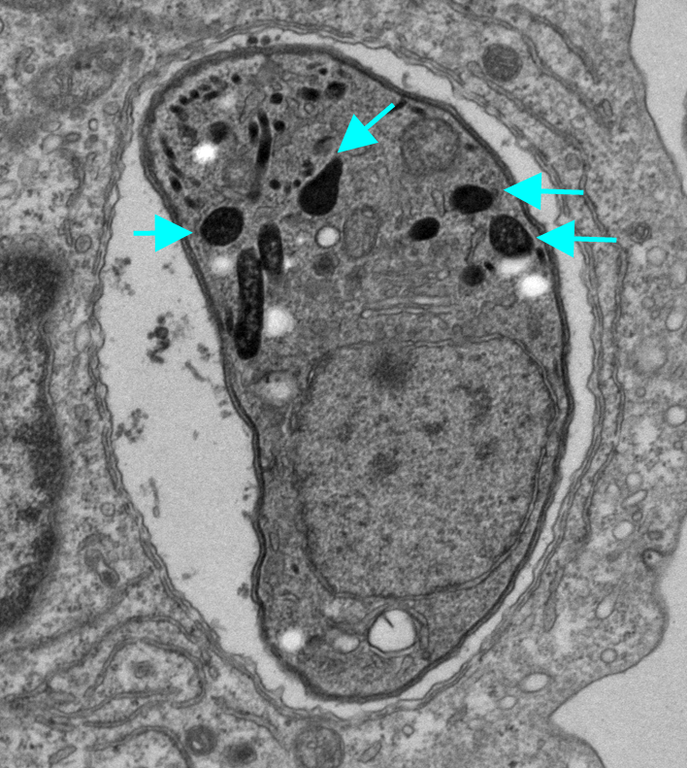
図1 トキソプラズマの電子顕微鏡写真
宿主の細胞の中に感染しているトキソプラズマの電子顕微鏡写真。
矢印の「デンスグラニュール(濃縮顆粒)」からGRAタンパク質が宿主細胞質に分泌される。
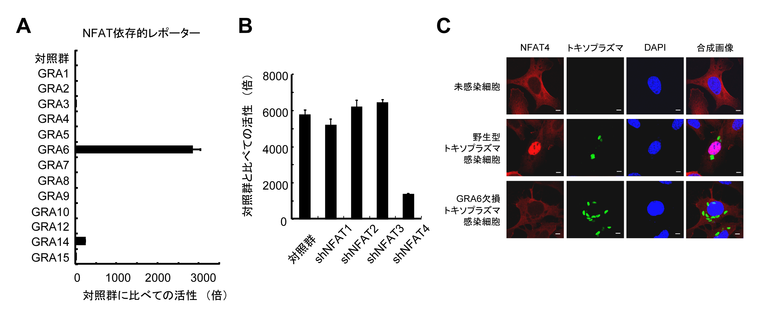
図2 GRA6依存的にNFAT4が選択的に活性化する
(A) GRAファミリータンパク質の中でGRA6が特にNFAT依存的レポーターを活性化する。
(B) NFAT4の発現が低下した細胞ではGRA6によるNFAT依存的レポーターの活性化が低下する。
(C) 野生型トキソプラズマ感染で見られるNFAT4の核移行(赤と青のシグナルの位置に着目)が、GRA6欠損トキソプラズマ感染ではみられない。
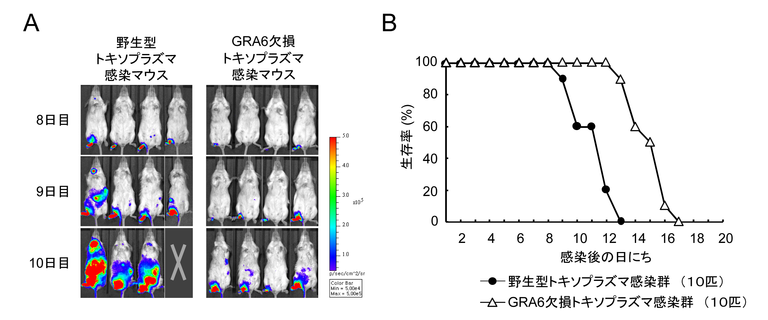
図3 病原性因子GRA6はトキソプラズマが、感染局所から全身性に感染拡大するのに重要である
(A) 野生型トキソプラズマは、GRA6欠損トキソプラズマよりも感染の左足からの感染拡大が速い。
(B) 野生型トキソプラズマ感染群よりも、GRA6欠損トキソプラズマ感染群の生存期間が長くなる。
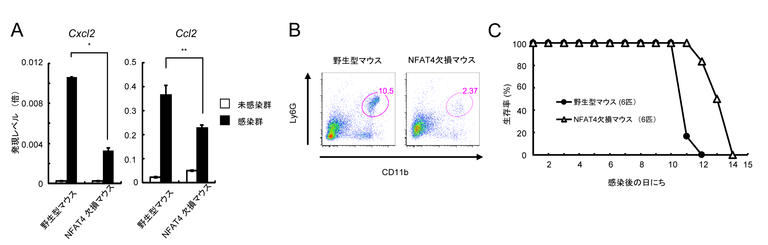
図4 NFAT4欠損マウスでは、野生型トキソプラズマ感染での病原性が低下する
(A) 野生型トキソプラズマが感染した野生型マウスの足蹠では、NFAT4欠損マウスの足蹠よりも好中球の遊走に重要な役割を果たすケモカイン(Cxcl2とCcl2)の発現レベルが高い。
(B) 野生型トキソプラズマ感染した野生型マウスの足蹠ではNFAT4欠損マウスの足蹠よりも、CD11b陽性Ly6G陽性細胞(好中球)の割合が多い。
(C) 野生型トキソプラズマ感染において、NFAT4欠損マウスは野生型マウスよりも生存期間が有意に延びている。
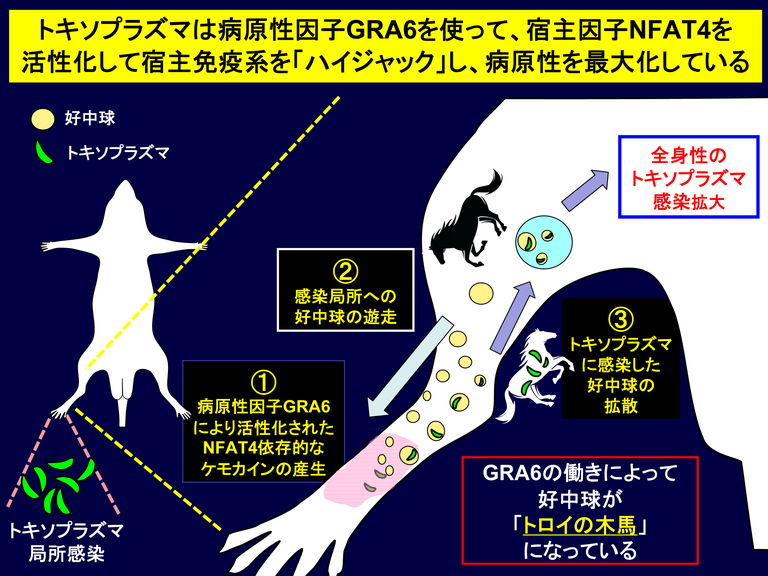
図5 今回明らかとなったトキソプラズマの病原性因子GRA6による宿主免疫ハイジャック機構
トキソプラズマが局所感染した後、①病原性因子GRA6により宿主転写因子NFAT4が活性化しケモカインが産生する。
次に、②ケモカインがあるために好中球が局所に遊走し、そこでトキソプラズマが好中球に感染する。
そして、③トキソプラズマが感染した好中球が全身に拡散していくことによって、トキソプラズマが局所から全身に感染拡大する。
すなわち、トキソプラズマは病原性因子GRA6を機能させ、宿主免疫系をハイジャックして、好中球を「トロイの木馬」化していることが明らかとなった。
-
論文詳細11
詳細を見る -
論文詳細10
詳細を見る -
論文詳細09
詳細を見る -
論文詳細08
ヒトの細胞で抗トキソプラズ免疫反応に重要な分子の同定
―宿主分子IDO1を中心とした宿主-病原体相互作用の解明―
Toxoplasma Effector TgIST Targets Host IDO1 to Antagonize the IFN-γ-Induced Anti-parasitic Response in Human Cells
詳細を見る -
論文詳細07
抗病原体分子をバランスよく配置して、免疫反応を効率化!
―GBP依存的な抗病原体免疫反応に重要な制御因子Gate-16の同定―
Essential role for GABARAP autophagy proteins in interferon-inducible GTPase-mediated host defense
詳細を見る -
論文詳細06
実験的トキソプラズマワクチンがどのように効くかを解明!
―宿主タンパク質 p62を標的とした新たなワクチンの開発に前進―
p62 Plays a Specific Role in Interferon-γ-Induced Presentation of a Toxoplasma Vacuolar Antigen
詳細を見る -
論文詳細05
世界初!寄生虫「トキソプラズマ」に対する免疫反応が大幅アップ!
―抗トキソプラズマ免疫反応のブレーキ役を果たす分子の同定―
RabGDIα is a negative regulator of interferon-γ-inducible GTPase-dependent cell-autonomous immunity to Toxoplasma gondii
詳細を見る -
論文詳細04
寄生虫「トキソプラズマ」は、どのように宿主の身体を乗っ取るか?
―高病原性因子 高病原性因子 GRA6「トロイの木馬」現象を引き起こす ―
Selective and strain-specific NFAT4 activation by the Toxoplasma gondii polymorphic dense granule protein GRA6.
詳細を見る -
論文詳細03
インターフェロン-ガンマ依存的な抗トキソプラズマ応答におけるオートファジー蛋白質の役割
Role of Mouse and Human Autophagy Proteins in IFN-γ-Induced Cell-Autonomous Responses against Toxoplasma gondii.
詳細を見る -
論文詳細02
CREBHによるスルピリンの副作用誘導機構
CREBHはスルピリンによって誘導される致死的ショックの重症度を決定する
CREBH Determines the Severity of Sulpyrine-induced Fatal Shock
詳細を見る -
論文詳細01
トキソプラズマ症の発病を防ぐ最重要宿主防御因子GBPの同定
インターフェロン誘導性タンパクGBPは寄生虫「トキソプラズマ」を破壊する
A Cluster of Interferon-γ-Inducible p65 GTPases Plays a Critical Role in Host Defense against Toxoplasma gondii
詳細を見る